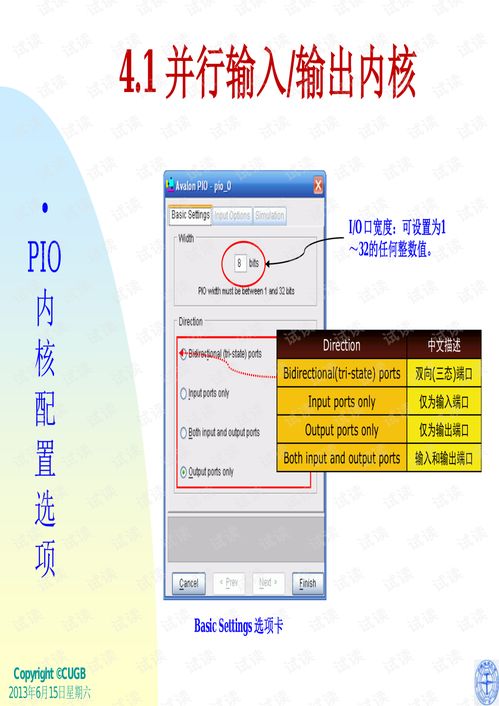
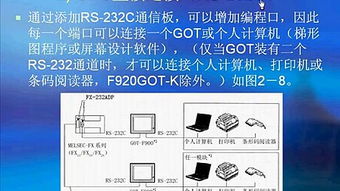
國務院進一步強化了對醫療器械的監管,明確提出并部署實施更為嚴格的法規與標準。這一舉措的核心目標之一,就是全面、高效地落實醫藥產品唯一標識(Unique Device Identification, UDI)追溯體系,以保障公眾用械安全,提升產業治理水平。在此背景下,通訊設備作為現代信息技術的載體,在實現這一追溯目標中扮演著不可或缺的關鍵角色。
一、 最嚴監管:聚焦全生命周期與唯一標識
國務院及相關監管部門(如國家藥監局)推動的“最嚴監管”,并非簡單的提高處罰力度,而是著眼于醫療器械的全生命周期管理,構建覆蓋產品注冊、生產、流通、使用直至報廢的全鏈條、數字化監管網絡。其核心抓手便是UDI系統。UDI相當于醫療器械的“電子身份證”,通過賦予每個產品或生產批次一個唯一的代碼,并關聯產品關鍵信息,實現精準識別與追溯。
實施最嚴監管,意味著:
- 強制性覆蓋:逐步擴大UDI實施的醫療器械品種范圍,高風險產品先行,最終目標是全面覆蓋。
- 數據標準統一:嚴格規范UDI的數據結構、載體(如一維碼、二維碼、射頻標簽)和發碼機構,確保全球和行業內的互認與互通。
- 責任主體明確:強化醫療器械注冊人/備案人的主體責任,要求其負責UDI的創建、維護和數據提交。
- 監管閉環形成:監管部門通過UDI數據庫,能夠實時或準實時地監控產品流向,快速應對不良事件,打擊假冒偽劣,實現智慧監管。
二、 滿足追溯需求:UDI系統的核心流程與挑戰
滿足嚴格的追溯要求,關鍵在于UDI系統的高效運行:
- 賦碼與數據關聯:生產環節,企業需按照標準為產品賦予UDI碼,并將產品名稱、規格型號、生產日期、有效期、批號、注冊證信息等關鍵數據關聯至UDI,并上傳至國家UDI數據庫。
- 流通環節掃碼與記錄:在經銷商、醫院庫房等流通節點,通過掃描UDI碼,記錄產品的收發存信息,實現物流與信息流的同步。
- 臨床使用與不良事件監測:在醫院,UDI碼可用于庫存管理、患者使用記錄關聯。一旦發生不良事件,可立即通過UDI精準定位問題產品批次,迅速實施召回或預警。
- 公眾查詢與監督:公眾或使用單位可通過掃碼等方式,驗證產品真偽,查詢基本信息,增強社會共治。
面臨的挑戰包括:企業需要改造生產線和信息管理系統以符合標準;全鏈條各參與方(生產、流通、醫院)信息系統兼容性與數據對接成本;海量數據的實時處理與安全隱私保護等。
三、 通訊設備的賦能作用:追溯體系的“神經網絡”
要實現上述嚴苛監管下的高效追溯,穩定、高速、泛在的通訊網絡與智能設備是基礎支撐,構成了追溯體系的“神經網絡”。
- 數據采集與傳輸的基石:在工廠、倉庫、手術室、藥店等場景,智能終端(如工業PDA、專用掃碼器、智能手機)、物聯網(IoT)設備(如RFID讀寫器)需要實時采集UDI數據。這些設備依賴有線/無線通訊網絡(如5G、Wi-Fi、藍牙、LPWAN)將數據即時傳輸至本地或云端管理系統,再匯聚至國家數據庫。高速、低延遲、廣覆蓋的通訊能力確保了追溯信息的實時性和完整性。
- 邊緣計算與實時處理:在復雜的醫院環境或物流樞紐,具備邊緣計算能力的通訊網關或智能設備可以在本地對UDI數據進行初步處理、校驗和過濾,減輕中心服務器的壓力,并能在網絡不穩定時暫存數據,確保追溯鏈路不中斷。
- 移動應用與遠程監管:監管人員通過配備專用通訊模塊的移動執法終端,可現場掃描UDI碼,即時聯網核查產品信息,實現移動辦公和遠程非現場檢查,提升監管效率與響應速度。
- 系統集成與平臺互聯:通訊協議和接口標準是連接企業ERP/WMS系統、第三方物流平臺、醫院SPD/HIS系統以及國家監管平臺的“語言”。統一的通訊標準確保了不同系統間UDI數據的順暢交換與共享。
結論
國務院實施對醫療器械的最嚴監管,本質上是推動行業向數字化、智能化、可追溯化轉型升級。滿足醫藥產品唯一標識(UDI)追溯要求,是一項復雜的系統工程,它不僅依賴于法規標準的完善和企業主體的落實,更離不開現代信息通訊技術的有力支撐。從生產線上的傳感器到醫院的智能終端,從高速的5G網絡到安全的云平臺,通訊設備與網絡如同無處不在的“血管”和“神經”,承載著UDI數據的流動,將監管要求轉化為可執行、可驗證的數字化流程,最終構筑起守護公眾生命健康的堅實防線。隨著物聯網、人工智能、區塊鏈等技術與UDI體系的深度融合,醫療器械的追溯將更加智能、透明與高效。